Künstliche Intelligenz (KI) beschreibt Technologien, die menschliche Intelligenz auf künstliche Weise nachahmen. Maschinelles Lernen (ML), ein Teilbereich der KI, ermöglicht es Algorithmen, aus Daten zu lernen. Diese Algorithmen reichen von simpler linearer Regression bis zu komplexem Deep Learning, welches komplexe neuronale Netzwerke für Aufgaben wie Bild- und Sprachverarbeitung nutzt. Neuronale Netze ahmen dabei die Funktionsweise des menschlichen Gehirns vereinfacht nach, ohne jedoch neurochemische Prozesse wie die Dopaminfreisetzung zu simulieren.
GMP als Reaktion auf Arzneimittelskandale
Das Interesse an KI reicht weit zurück: Bereits 1770 wurde ein mechanischer Automat von Jaquet-Droz entwickelt, der Briefe schreiben konnte. Der Begriff «Künstliche Intelligenz» entstand jedoch erst 1956 [1]. Wichtige Fortschritte in den letzten Jahrzehnten umfassen den Sieg des Schachcomputers Deep Blue über den Weltmeister Garry Kasparov im Jahr 1997 sowie neuere Innovationen wie die Sprachsteuerung Siri (2011) und das Sprachmodell GPT-3 (2020). Die Integration von KI in GMP-konforme Prozesse bleibt jedoch eine Herausforderung, da regulatorische Anpassungen meist langsamer erfolgen.
Good Manufacturing Practice (GMP) entstand als Reaktion auf Arzneimittelskandale wie die Thalidomid-Tragödie [2] der 1950er Jahre, die schwere Geburtsfehler zur Folge hatte und die Notwendigkeit strenger Sicherheitsstandards in der Pharmaindustrie verdeutlichte. Im Jahr 1992 führte die EU Annex 11 ein, der sich auf die Regulierung von Computersystemen in der pharmazeutischen Produktion konzentriert. In den USA wurde dies durch 21 CFR Part 11 ergänzt.
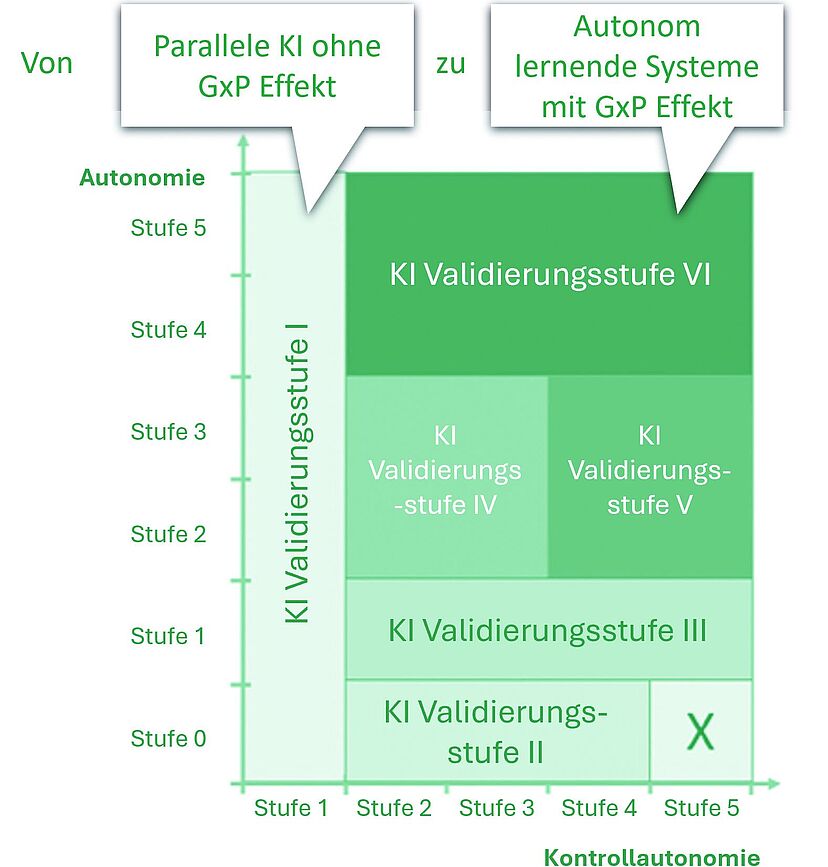
Die Einbindung von KI in eine GMPUmgebung bringt spezifische Anforderungen mit sich. Die Daten, die für KI verwendet werden, müssen insbesondere hinsichtlich ihrer Integrität den GMPStandards entsprechen. Zudem müssen KI-Modelle regulatorische Vorgaben erfüllen, um eine sichere Produktion zu gewährleisten. Die FDA arbeitet seit 2014 an entsprechenden Richtlinien und unterstützt KI durch Initiativen wie die «Pharmaceutical Quality Initiative» und das «Emerging Technology Program» [3], um moderne Technologien in die Arzneimittelproduktion zu integrieren. Dabei betont die FDA stets, dass KI helfen kann, Prozesse zu optimieren, Trends zu überwachen und die Produktion zu analysieren [4]. Allerdings sind viele Vorschriften noch nicht vollständig ausgearbeitet. Auf europäischer Seite entwickelte die DACH-Arbeitsgruppe der International Society for Pharmaceutical Engineering (ISPE) ein KI-Reifegradmodell, das zur Bewertung und Validierung von KI-Systemen [5] dient. Dieses unterstützt die Pharmaindustrie bei der Entwicklung von Richtlinien zur Risikobewertung und Qualitätssicherung. Es beschreibt die Reife eines KI-Systems und dessen Fähigkeit, autonome Entscheidungen zu treffen. Das Modell bewertet, wie gut das System Prozesse steuern und autonome Entscheidungen treffen kann – mit dem Ziel, die Qualität und Patientensicherheit zu gewährleisten. Es umfasst eine zweidimensionale Matrix, um die Reife eines KI-Systems zu messen, und legt erforderliche Validierungsmaßnahmen fest (Abbildung 1).
Grundlagen der KI-Validierung [5]
Das KI-Reifegradmodell teilt KI-Systeme in verschiedene Validierungsstufen ein, die unterschiedliche Kontrollmassnahmen erfordern. Diese Stufen helfen dabei, KI-Systeme je nach Risikoprofil zu klassifizieren und die jeweils notwendigen Massnahmen zu definieren.
KI-Validierungsstufen in der pharmazeutischen Industrie
❱ Validierungsstufe I: Keine Produktqualität, Patientensicherheit oder Datenintegrität gefährdet; formale Validierung ist nicht notwendig, menschlicher Faktor bleibt wichtig.
❱ Validierungsstufe II: Anwendungen, die nicht auf maschinellem Lernen basieren; Ergebnisse sind deterministisch und können traditionell validiert werden.
❱ Validierungsstufe III: Systeme mit ML oder Deep Learning, die Training erfordern. Die Validierung umfasst KI-spezifische Massnahmen zur Sicherstellung der Datenintegrität und -qualität.
❱ Validierungsstufe IV: Anwendungen mit hoher Autonomie, die kontinuierliche Überwachung und regelmässige Leistungsmetriken zur Sicherstellung der Modellqualität erfordern.
❱ Validierungsstufe V: Systeme, die den Produktionsprozess umfassender steuern; regelmässige Tests und Systemüberwachung sind notwendig.
❱ Validierungsstufe VI: selbstlernende Systeme, die aktuell kein etabliertes Validierungskonzept haben und regulatorische Herausforderungen darstellen.
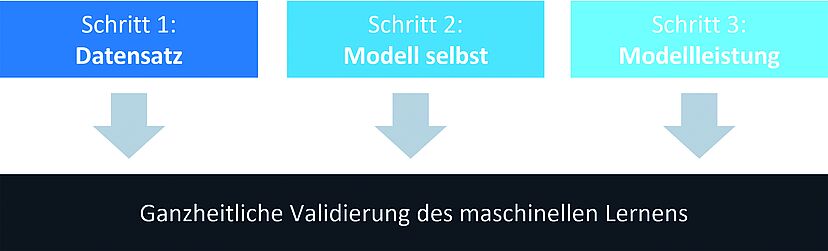
Ein umfassender Validierungsprozess kombiniert verschiedene Disziplinen wie Data Science, maschinelles Lernen, Statistik sowie Prozessingenieurwesen und GMP-Konformität, um die Anwendbarkeit eines KI-Algorithmus sicherzustellen. Der von VTU vorgeschlagene Prozess umfasst drei Phasen für KI-Systeme der Validierungsstufe III (Abbildung 2).
- Bewertung der Datenqualität, um sicherzustellen, dass Datensätze repräsentativ und verzerrungsfrei sind.
- Analyse der Modellstruktur zur Erfüllung der Produktionsanforderungen und Erfassung komplexer Zusammenhänge.
- Validierungsmethoden zur Bewertung der Vorhersagegenauigkeit, einschliesslich Metriken wie Genauigkeit und Präzision, um die Zuverlässigkeit der KI-Modelle zu gewährleisten.
Dieser Validierungsansatz dient als Leitfaden für verschiedene KI-Anwendungen, insbesondere in der Prozessüberwachung und -steuerung. Eine gründliche Validierung ist die Grundlage für die Integration von KI-Technologien in regulierte Branchen wie die Pharmaindustrie.
Fazit
Insgesamt zeigt sich, dass die hochregulierte Industrie zunehmend das Potenzial von KI zur Effizienzsteigerung und Qualitätsverbesserung anerkennt. Trotz aller Fortschritte bleibt jedoch die Einhaltung der GMP-Vorgaben zentral. Die Zusammenarbeit zwischen Industrie und Behörden wie der FDA verdeutlicht das gemeinsame Ziel, KI-Technologien zu entwickeln und umzusetzen, die höchste Standards erfüllen. Es ist die Verantwortung der Industrie, sicherzustellen, dass KI-Anwendungen nicht nur effektiv sind, sondern auch sicher und konform mit den regulatorischen Anforderungen arbeiten.